Introducción
Es sabido que la construcción de una tabla periódica1 requiere de dos pasos o instancias, a saber: (1) ordenar los elementos químicos de acuerdo con su número atómico creciente, lo cual da lugar a la denominada 'línea de Mendeleev'; y (2) la 'línea de Mendeleev' se particiona con el propósito de agrupar elementos en familias químicamente similares. El resultado son los periodos y los grupos.
En la actualidad son varios los candidatos a constituirse en el criterio para clasificar elementos en grupos: la espectroscopía, la electronegatividad, la estructura electrónica, la configuración electrónica, así como las triadas de elementos, un criterio propuesto en los últimos años. En general, es ampliamente aceptado que la configuración electrónica externa (o de la capa de valencia) establece el criterio de clasificación secundaria, aunque de manera no tan categórica como el criterio primario dado por el número atómico.
El criterio mecánico cuántico – es decir, el uso de orbitales y configuraciones electrónicas popularizado en las representaciones del sistema periódico por L. M. Simmons y V. M. Klechkovskii (MAZURS, 1974) – es el enfoque moderno para explicar la periodicidad química. De acuerdo con el enfoque reduccionista que hoy domina en el ámbito de la ciencia química, el comportamiento químico de un elemento encuentra su mejor explicación en un dominio de partículas, en particular, vía su configuración electrónica dada por la denominada regla de Madelung-Klechkowskii (o regla n + l, donde n y l denotan los dos primeros números cuánticos), la cual brinda el orden en que se completan los orbitales de átomos en fase gaseosa, a saber:
1s < 2s < 2p < 3s < 3p < 4s < 3d…
Como fue señalado, la configuración de la capa de valencia parece gobernar la química de los elementos. Esta afirmación se asume, en general, como ‘cosa juzgada’ e impregna fuertemente la enseñanza del tema. Sin embargo, Eric Scerri (SCERRI, 2010) ha destacado que a pesar de que la mecánica cuántica proporciona una excelente manera de calcular las propiedades de los elementos individuales, no sucede lo mismo cuando se trata de determinar ‘propiedades globales’, esto es, la membresía de elementos en grupos particulares. La idea según la cual los elementos en el mismo grupo de la tabla periódica comparten la misma configuración electrónica de la capa externa del átomo muestra excepciones que pueden encontrarse entre los metales de transición (por ej. níquel, paladio y platino en el grupo 102). En este sentido, la mecánica cuántica no ha resuelto satisfactoriamente la posición de estos elementos debido a que "La periodicidad en las propiedades químicas de los elementos es un tema complejo y sólo se refleja aproximadamente en las configuraciones electrónicas de los átomos" (SCERRI, 1991, p. 122, nuestra traducción). Sobre esta base, coincidimos con Scerri (2007, p. 242, nuestra traducción) cuando afirma que "[...] la posesión de un determinado número de electrones en la capa externa no es condición necesaria ni suficiente para la pertenencia de un elemento en cualquier grupo particular". Un ejemplo de ello es el caso del elemento torio (90), un actinoide perteneciente al bloque f que, sin embargo, presenta la configuración [Rn] 6d2 7s2. Como afirma JORGENSEN (1973, p. 14, nuestra traducción): "No existe la más mínima duda, sin embargo, de que no existe una relación simple entre la configuración electrónica en el estado basal del átomo neutro y la química del elemento en consideración". En tal sentido, entendemos que dicha imposibilidad está basada en dos factores que habitualmente no se explicitan. El primero de ellos es de índole técnica y concierne con la naturaleza aproximada del modelo orbital. En efecto, la idea de asignar electrones a orbitales consiste en adscribir cuatro números cuánticos a cada electrón en átomos multielectrónicos. Pero la mecánica cuántica formulada en 1926 muestra que sólo el átomo en su conjunto posee estados estacionarios. Esto implica que es estrictamente incorrecto adscribir electrones individuales (e indistinguibles) a estados estacionarios para dichos átomos. Scerri (1991) ha advertido acerca de esta limitación. Y el segundo factor es de naturaleza filosófica. La manifiesta imposibilidad de reducir el comportamiento químico de un elemento a la configuración electrónica de su átomo en su estado basal debería recordarnos que toda teoría científica tiene un dominio de aplicación y, pese a sus grandes éxitos predictivos en química, la mecánica cuántica no puede eludir este punto, reconocido por la filosofía contemporánea de la ciencia. A continuación, expondremos un caso de estudio que muestra el problema epistemológico y disciplinar en relación con la membresía de los elementos en el grupo 3.
El problema de los elementos pertenecientes al grupo 3
En abril de 2015 un equipo internacional de investigadores comunicaba que había logrado medir la primera energía de ionización del laurencio, un elemento superpesado de número atómico 103 (SATO et al., 2015). El resultado experimental, publicado en la prestigiosa revista científica Nature, generaba importantes repercusiones en las comunidades química y física (cfr. por ejemplo, CASTELVECHI, 2015; KEMSLEY, 2015) y, al mismo tiempo, daba lugar a la reapertura de un antiguo y complejo debate que concierne a los elementos que deben formar parte del grupo 3 de la tabla periódica.
En general, la tabla periódica tradicional que se enseña en nuestras escuelas y universidades incluye los elementos escandio (Z = 21), itrio (Z = 39), lantano (Z = 57) y actinio (Z = 89). Sin embargo, es posible encontrar varias representaciones del sistema periódico de comienzos del siglo XX donde estos dos últimos elementos eran reemplazados por lutecio (Z = 71) y laurencio (Z = 103) (MAZURS, 1974). De acuerdo con Jensen (1982), el consenso mencionado parece haberse instaurado progresivamente a partir de la década de 1940, cuando la mecánica cuántica se fue cristalizando como el enfoque moderno para explicar la periodicidad química (cfr. por ejemplo, LUDER, 1943). En la actualidad, varios químicos, educadores en química y filósofos de la química consideran que los dos últimos elementos del grupo deberían efectivamente sustituirse por lutecio y laurencio, respectivamente. Este problema epistemológico y disciplinar presenta ya varias décadas de un intenso debate (cfr.CLARK; WHITE, 2008; HAMILTON; JENSEN, 1963; JENSEN, 1982, 2015; LABARCA; MARTÍNEZ GONZÁLEZ, 2019; LANDAU; LIFSHITZ, 1959; LAVELLE, 2008; LUDER, 1943; MATTHIAS et al., 1967; SCERRI, 2009, 2011, 2019a, 2019b; SCERRI; PARSONS, 2018; XU; PYYKKO, 2016). En este contexto, la International Union of Pure and Applied Chemistry ha conformado un comité de estudio que se propone hacer una recomendación sobre el tema en cuestión (IUPAC, 2015).
El trabajo que suele tomarse como punto de partida en la discusión filosófica sobre el tema es el del químico estadounidense William Jensen (JENSEN, 1982). En el mismo, el autor ponía de relieve que las configuraciones electrónicas de la capa de valencia (n-1) d1 ns2 no constituyen un criterio categorial que permita elucidar el problema, ya que el La y el Lu, así como el Ac y el Lr, son candidatos de igual derecho a integrar el bloque d de elementos, debajo del Sc y del Y, en los períodos 6 y 7 de la tabla periódica.
El La y el Ac son elementos de transición pertenecientes al bloque d del sistema periódico. Cuando se aprecian las configuraciones de los átomos de estos elementos, parecen pertenecer, a priori, al bloque f. Pero desde hace algunas décadas se conocen los fuertes efectos relativistas presentes en el Lr, los cuales producen una configuración electrónica anómala de acuerdo con su posición en el sistema periódico (DESCLAUX; FRICKE, 1980). Ya en 1971 se sugería la nueva configuración teórica para este elemento [Rn] 5f14 7s2 7p1 (BREWER, 1971), la cual fue recientemente corroborada (SATO et al., 2015).
Veamos entonces cuáles son las configuraciones electrónicas externas de los dos pares de elementos involucrados en el debate:
versus
Frente a la dificultad que presentan las configuraciones electrónicas para decidir que par de elementos deben formar parte del bloque d en los periodos 6 y 7, Jensen (1982) señalaba que es necesario considerar analogías intraperiodos e intragrupos. Para ello, recurrió a propiedades tales como el radio atómico, la suma de los dos primeros potenciales de ionización, el punto de ebullición y la electronegatividad con el propósito de examinar la variación que manifiestan entre los elementos que integran los metales de transición. Este análisis comparativo muestra una mayor regularidad en la secuencia Sc–Y–La respecto de la secuencia Sc–Y–Lu. El autor agregaba que se aprecia igual resultado cuando se comparan otras propiedades fisicoquímicas como puntos de fusión, estructuras cristalinas a temperatura ambiente, etc.
Laurence Lavelle (LAVELLE, 2008) ha manifestado una clara oposición al intento de desplazar al bloque d de elementos al Lu y al Lr y colocarlos bajo el Y. Si el La y el Ac fueran desplazados del grupo 3, tales elementos deberían encabezar el bloque f, resultado que este autor encuentra inaceptable dado que los átomos de tales elementos poseen un electrón en el orbital d pero están ausentes en el orbital f, lo que no ocurre en el caso del Lu y del Lr. La configuración electrónica en el estado basal calculada del Lr, afirma Lavelle, justificaría reposicionarlo debajo del elemento talio (Z = 81) en el grupo 13, es decir, formando parte del bloque p y no del bloque d, como se pretende. Esta alternativa no es adecuada para Lavelle, lo cual conduce a que el Lr debe permanecer integrando el bloque f de elementos. Eric Scerri (SCERRI, 2009) ha enfrentado este argumento impugnando la idea según la cual la posesión de un electrón f en la capa de valencia es un requisito para que un elemento pertenezca al (nominalmente llamado) bloque f. Este autor brinda como ejemplo el caso del elemento torio (Z = 90), cuya configuración es [Rn] 6d2 7s2, que forma parte de dicho bloque de elementos pese a no poseer electrones externos en dicho orbital.
Lavelle (2008) afirma, asimismo, que los argumentos esgrimidos por Jensen (1982) respecto de las propiedades físicas y químicas de los elementos en disputa son plausibles, aunque sólo para el Lu. Pese a ello, objeta el autor, existen muchos elementos con propiedades o tendencias similares en sus propiedades que no forman parte del mismo grupo. Las conocidas 'relaciones diagonales' (litio y magnesio, berilio y aluminio, boro y silicio) son un ejemplo de ello (para detalles acerca de las relaciones diagonales, véase HANUSA, 1987; RAYNER-CANHAM, 2011). En consecuencia, se pregunta: ¿por qué no integran el mismo grupo de elementos? Lavelle (2008) responde esta pregunta afirmando que la ubicación actual de los elementos en la tabla periódica es una aceptada combinación y balance de factores que se basan en las siguientes observaciones empíricas: número atómico, propiedades fisicoquímicas, tendencias periódicas y configuración electrónica en el estado basal.
Si bien Lavelle (2008) parece defender un enfoque no reduccionista, su posición parece resultar inconsistente cuando, en defensa de mantener el La y el Ac en el bloque d, sugiere el siguiente ejemplo a los docentes luego de discutir configuraciones electrónicas y tabla periódica: tenemos dos elementos que pertenecen a un mismo grupo y cuyas configuraciones electrónicas son [Xe] 5d1 6s2 y [Rn] 6d1 7s2. Luego pregunta dónde se esperaría encontrarlos en la tabla periódica. Y su respuesta revela la posición filosófica del autor, al señalar que si se utilizaran textos que ubican ambos elementos (La y Ac) en el bloque f, ello generaría toda clase de problemas a los estudiantes.
La discusión acerca de la ubicación del Lr revela las limitaciones que presentan las configuraciones electrónicas de los átomos cuando se trata de decidir su pertenencia a un bloque de elementos. Esto es expresado explícitamente por uno de los investigadores japoneses que hicieron el anuncio en Nature, Yuichiro Nagame, cuando afirma: "Sin embargo, estas mediciones pueden servir para respaldar la posición del laurencio como un actínido en el bloque f, un metal de transición en el bloque d, o bien como un elemento del bloque p…" (NAGAME, 2016, p. 282, nuestra traducción).
Eric Scerri (SCERRI, 2011), frente a criterios basados en configuraciones electrónicas, así como en propiedades físicas y químicas que no considera completamente categóricos para resolver el problema, ha apelado al enfoque de las triadas de elementos. En 1829 el químico alemán Johann Wolfgang Döbereiner presentaba la tesis según la cual algunos elementos, que podían agruparse de a tres, manifestaban semejanza química y una particular relación aritmética: el peso atómico (o peso equivalente) del segundo elemento en una triada dada era casi exactamente el promedio de los otros dos elementos. Ya en el siglo XX, y desplazada dicha propiedad como criterio unívoco para ordenar el sistema periódico, el número atómico se convirtió en la propiedad que permite caracterizar adecuadamente los elementos. Y Scerri (2011) sugería entonces preservar o crear nuevas triadas de elementos – pero ahora de número atómico, es decir, triadas exactas– como posible criterio categorial para representar la periodicidad química. De acuerdo con este criterio, Scerri (2011) propone entonces reemplazar el lantano y el actinio por el lutecio y el laurencio, dada la tríada 'perfecta' de número atómico que quedaría conformada: Y (39), Lu (71), Lr (103). Para argumentos en favor y en contra del uso de triadas como criterio categorial, véase Bent (2006), Laing (2009), Scerri (2010) y Schwarz (2010).
Otra línea argumentativa recientemente propuesta para intentar elucidar este problema se basa en la identificación y el análisis conceptual de los principales criterios para clasificar elementos en grupos (LABARCA; MARTÍNEZ GONZÁLEZ, 2019). Los autores señalan que a la luz de las dificultades conceptuales que presentan las configuraciones electrónicas, la electronegatividad y las triadas de elementos para clasificar unívocamente elementos en grupos, en el caso del complejo problema de la posición del hidrógeno y del helio en el sistema periódico los tres criterios poseen el mismo estatus epistémico. Esto implica que ninguno de ellos presenta prioridad explicativa cuando se trata de decidir la posición de tales elementos en la tabla, hasta nueva evidencia o nuevos argumentos (LABARCA; SRIVATHS, 2016). Algunos autores han mostrado objeciones respecto de este enfoque (cfr. CVETKOVIC; PETRUSEVSKI, 2017; SCERRI, 2017; para una defensa del mismo, véase LABARCA; SRIVATHS, 2017).
Sobre la base de la solución propuesta para este problema, Labarca y Martínez González (2019) extrapolan dicho argumento al debate que presenta la membresía del grupo 3. Cuando los tres criterios mencionados son evaluados respecto de la posición del par La-Ac versus Lu-Lr, se aprecia que la solución propuesta consiste en una suerte de 'balance' o de 'relación democrática' entre la mecánica cuántica, la electronegatividad y las triadas de elementos. Y al considerarlos en forma simultánea, el Lu y el Lr deben efectivamente formar parte del grupo 3 en los periodos 6 y 7 del sistema periódico.
Hasta aquí hemos reseñado las dos perspectivas propuestas respecto de este problema en la tabla periódica estándar o de longitud media. Por un lado, el tradicional agrupamiento Sc, Y, La, Ac que se observa en buena parte de las tablas publicadas en los textos de química de nivel universitario a la fecha (cfr. por ejemplo, ATKINS; de PAULA, 2010; CHANG, 2010; OXTOBY; GILLIS; CAMPION, 2012; SILBERBERG, 2006; WHITTEN et al., 2015; ZUMDAHL; ZUMDAHL, 2010) y, por otro, el enfoque que sugiere fuertemente que el grupo 3 debería estar conformado por los elementos Sc, Y, Lu y Lr sobre la base de los argumentos explicitados. En relación con las configuraciones electrónicas, como vimos, los argumentos no parecen convincentes para decidir su reemplazo. Pero una tercera alternativa ha sido sugerida por Wen-Hua Xu y el destacado químico cuántico finlandés Pekka Pyykkö.
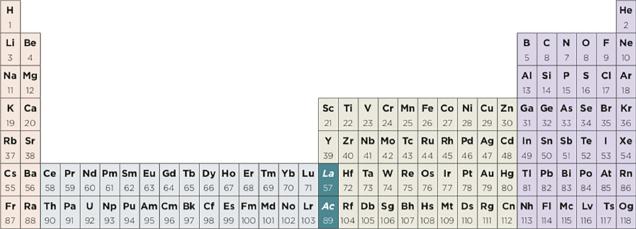
En su trabajo, Xu y Pyykkö (2016) exploran la química del elemento laurencio. A partir de un detallado trabajo donde analizan sus potenciales de ionización, así como estudios moleculares de sus hidruros, monocarbonilos y sus tricloruros, y complejos divalentes, los autores sugieren mantener el lutecio y el laurencio entre los lantanoides y actinoides, respectivamente. Para arribar a dicha conclusión, privilegian el comportamiento químico en los sistemas mencionados por sobre la configuración electrónica del estado basal del átomo. La propuesta de Xu y Pyykkö (2016) implicaría entonces dos filas de 15 elementos f, La-Lu y Ac-Lr, en lugar de los 14 elementos vistos hasta aquí en las dos propuestas reseñadas. La representación de los elementos que se obtiene va en la misma dirección que la que puede apreciarse en la tabla periódica que se publica en el sitio de la IUPAC (2015) a la fecha (figura 1). Sin embargo, es importante resaltar que ninguna forma específica de la tabla periódica ha sido aprobada por dicha institución; sólo favorece la representación en 18 columnas (LEIGH, 2009).
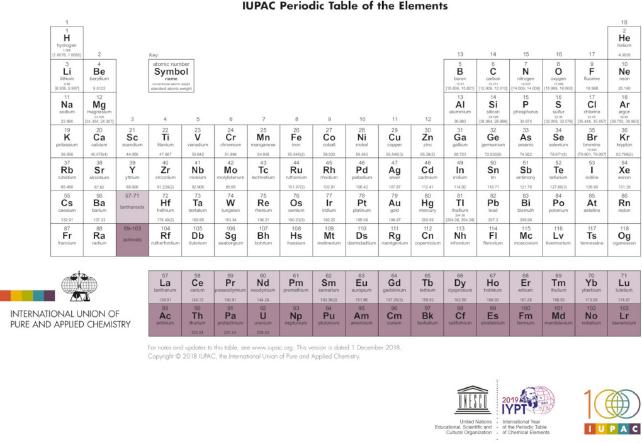
Fuente: https://iupac.org/what-we-do/periodic-table-of-elements/.
Figura 1 Tabla periódica convencional, de longitud media o de 18 columnas
Hasta aquí hemos expuesto las diferentes líneas argumentativas propuestas respecto del problema bajo estudio que conciernen la tabla periódica de 18 columnas. Veamos a continuación otras propuestas de solución de este caso de estudio que toman como eje del análisis la tabla periódica extendida o de 32 columnas.
Scerri y Parsons (2018) han presentado un nuevo argumento en favor de la sustitución anterior que consideran conclusivo. Los autores afirman que tanto los argumentos basados en las configuraciones electrónicas como los datos de las propiedades físicas y químicas, si bien sugieren que el grupo 3 debería estar conformado por Sc, Y, Lu y Lr, no son realmente determinantes para decidir de forma fehaciente la nueva membresía. En particular, los autores observan que el análisis de la suma de las tres primeras energías de ionización, y no de las dos primeras tal como mostrara Jensen (1982), revela que el lantano muestra una mayor regularidad que el laurencio, por lo cual debería conservar su posición en el grupo.
A la luz de este escenario, Scerri y Parsons (2018) presentan entonces un argumento que se monta sobre tres requisitos. El primero de ellos requiere la forma extendida (o de 32 columnas) del sistema periódico. Es sabido que la misma es más adecuada para la representación de los elementos que la forma tradicional de 18 columnas, ya que los lantanoides y actinoides forman parte del cuerpo principal de la tabla, a diferencia de la tabla estándar donde se encuentran en un bloque separado, generalmente representado por encima o por debajo del cuerpo principal.
El segundo requisito es que los elementos sean ordenados secuencialmente según el incremento en su número atómico, a medida que se progresa en la tabla de izquierda a derecha a lo largo de cada periodo. Finalmente, al ir completando secuencialmente los bloques que conforman el sistema periódico, el orden en que se completan orbitales debería seguir la regla de Madelung, es decir, valores crecientes de n + l o la suma de los dos primeros números cuánticos. Y en los casos en que se manifiesta una igualdad en la suma, debería privilegiarse el orden creciente del número cuántico principal n. Sobre la base de estos tres requerimientos, Scerri y Parsons muestran entonces que, en la tabla periódica extendida, o de 32 columnas, el grupo 3 debería estar formado por los elementos Sc, Y, Lu y Lr.
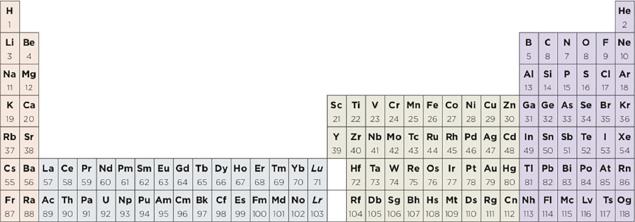
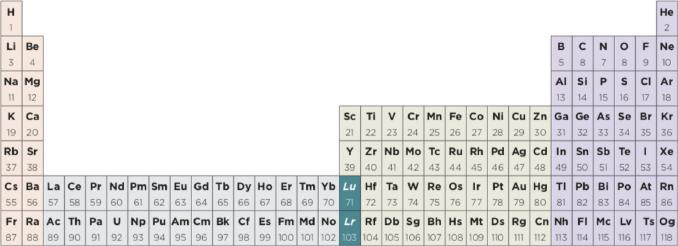
Más recientemente, Scerri (2019a) ha abordado el problema una vez más, presentando un nuevo argumento en favor de la sustitución del La y Ac por Lu y Lr. En su análisis vuelve a abogar por expandir la tabla periódica a 32 columnas. La ventaja, afirma, es que cada elemento estaría ubicado en su correcta secuencia de acuerdo con su número atómico creciente, al moverse a través de cada periodo de izquierda a derecha. Si se adoptara entonces el sistema periódico de 32 columnas, tres posibles resultados son esperados respecto del ordenamiento del grupo 3 (figuras 2, 3 y 4, respectivamente).
En la figura 2 se aprecia que el grupo 3 quedaría formado por Sc, Y, La y Ac. Sin embargo, la secuencia de números atómicos crecientes se ve alterada. En la segunda opción (figura 3), el bloque f contiene 15 elementos y el grupo 3 sólo dos (Sc, Y). Finalmente, la tercera alternativa (figura 4) muestra que el grupo 3 está conformado por Sc, Y, Lu y Lr respetando los números atómicos crecientes. En un trabajo posterior, este autor favorece ahora la tabla periódica de Janet y argumenta como una de sus virtudes las triadas de elementos químicos (SCERRI, 2019b).
Reflexiones finales
A partir del debate generado entre químicos y filósofos de la química acerca de los elementos que deberían conformar el grupo 3, se evidencia la importancia que tiene esta cuestión abierta y relevante para la comunidad científica. Así, en este primer artículo, nos ha interesado relevar un problema científico y filosófico, que nos permite comprender la dinámica de las ideas científicas, las posiciones filosóficas en disputa y cómo se va reconfigurando el conocimiento de la ciencia química, en un proceso continuo, dinámico y permanente, de manera análoga a cómo nuestros estudiantes lo aprenden. Sin embargo, es posible afirmar que, en general, para la enseñanza de la química la tabla periódica ha funcionado en contra de esta misma lógica. Esto ocurre cuando se ha obligado a aprenderla de memoria, cuando se la presenta de manera ahistórica, olvidando que el encaje de las piezas que la componen (las propiedades de los átomos, las propiedades de las sustancias) plantea retos constantes a la investigación en química y en educación química. Al respecto, existe un amplio consenso en la comunidad internacional en enseñanza de las ciencias acerca de la relevancia del lenguaje y de los procesos comunicativos para aprender a pensar con teoría en la clase de química. Es con estas finalidades que en la segunda parte de este trabajo desarrollaremos en profundidad los aspectos históricos y didácticos de la tabla periódica, introduciendo en el contenido del mismo porqué es mejor una respuesta que otra, lo que supone al profesorado de química enseñar a cómo elaborar textos argumentativos y explicaciones en el aula. Proporcionaremos así elementos teóricos diversos, controversiales y actuales sobre los desafíos de la explicación y la argumentación en la enseñanza y aprendizaje de la química, con una propuesta de intervención en el aula de secundaria que hemos venido adelantando con estas finalidades.